利益相反管理
利益相反管理について
利益相反(COI)申告者は、企業等が製造または販売する、もしくは製造または販売しようとする医薬品・医療機器等を用いる研究を行なう場合には、自身の所属機関に【様式C】を提出し、助言・指導を受け確認結果を受領することが定められています。研究責任医師は、所属機関にて『様式C』の確認を行い、『様式D』を入手したうえで、当臨床研究審査委員会へ『様式A及びE』を提出してください。
利益相反管理の流れ・プロセス
プロセス
臨床研究法における標準的な利益相反管理のプロセスは以下のように整理されます。(厚生労働省発令「臨床研究法における臨床研究の利益相反管理について 医政研発 0302 第1号」より)
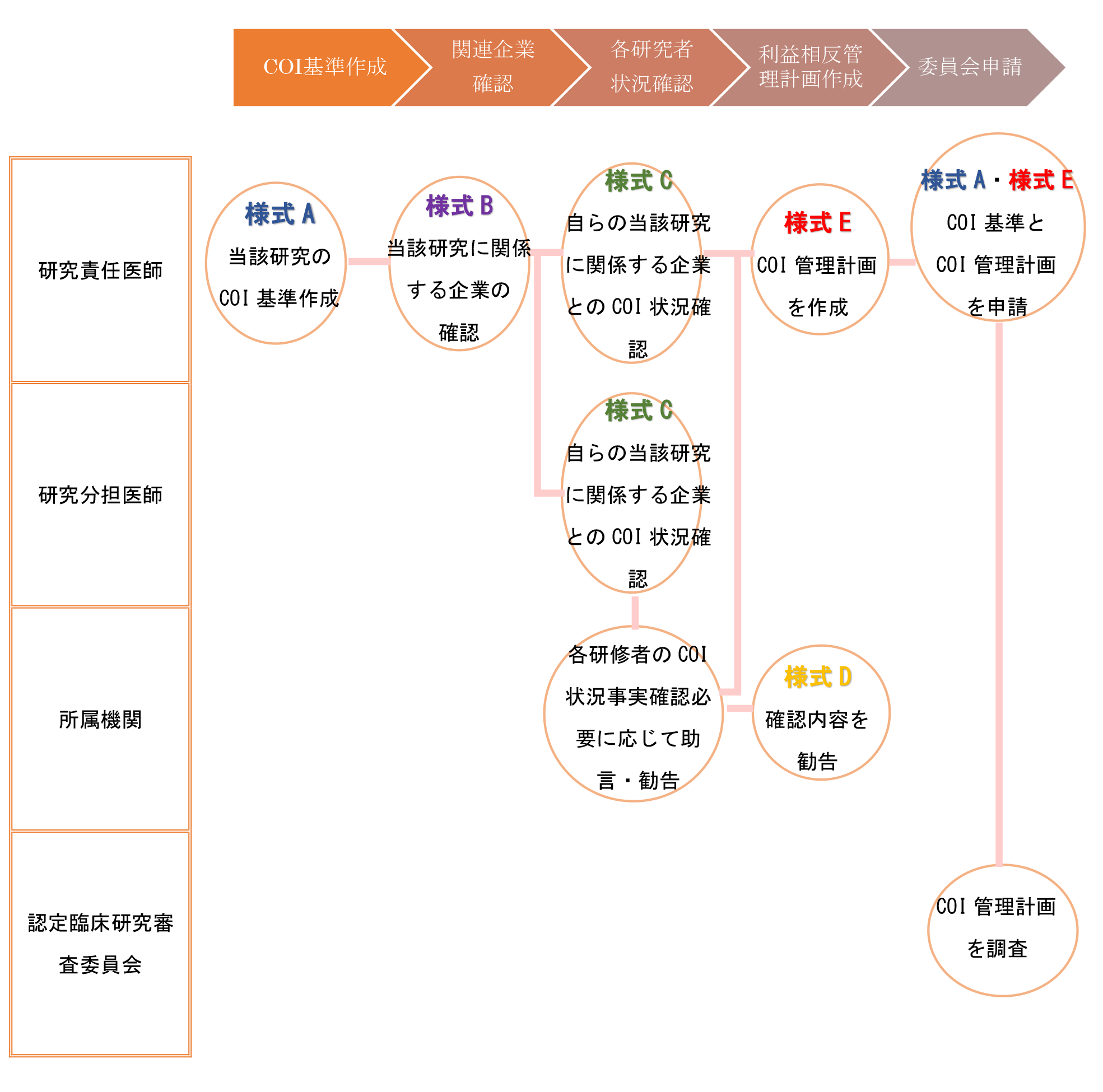
- 研究責任医師は、利益相反管理基準を作成する。『様式 A 利益相 反管理基準』
- 研究責任医師は、研究への企業の関与の内容を確定し、利益相反管理基準に基づき、当該研究への企業の関与に関する利益相反管理計画を作成する。『様式 B 関係企業等報告書』
- 研究責任医師は利益相反申告者を確定した上で、当該利益相反申告者に対して個人収入等の申告書の作成『様式 C 研究者利益相反自己申告書』を依頼する。
⇒利益相反申告者:研究責任医師、研究分担医師、統計解析責任者となる。 - 利益相反申告者は、『様式 C』に個人収入等を記入し、所属機関に『様式 C』を提出する。その際、研究責任医師は併せて『様式 A』を提出する。
- 所属機関は、提出された申告内容に関係する事実確認を行い、必要に応じて申告者に助言・指導を行った上で(※)、最終的な確認結果を研究責任医師に提供する『様式 D 利益相反状況確認報告書』。なお、『様式 D』の写しは申告者にも送付する。
※これまでこの過程は利益相反管理委員会が審議していた箇所であるが、本ガイダンスは必ずしも委員会審議を前提としていない。事実確認等については必要な情報を有している部署が対応し、助言・勧告等が必要な場合には利益相反委員会等の意見を聴くこととして差し支えない。 - 研究責任医師は『様式 A』、『様式 B』及び『様式 D』の内容を確認し、説明文書の修正等の必要な措置を講じた上で、認定臨床研究審査委員会に対して利益相反管理計画を提出する『様式E 利益相反管理計画』。
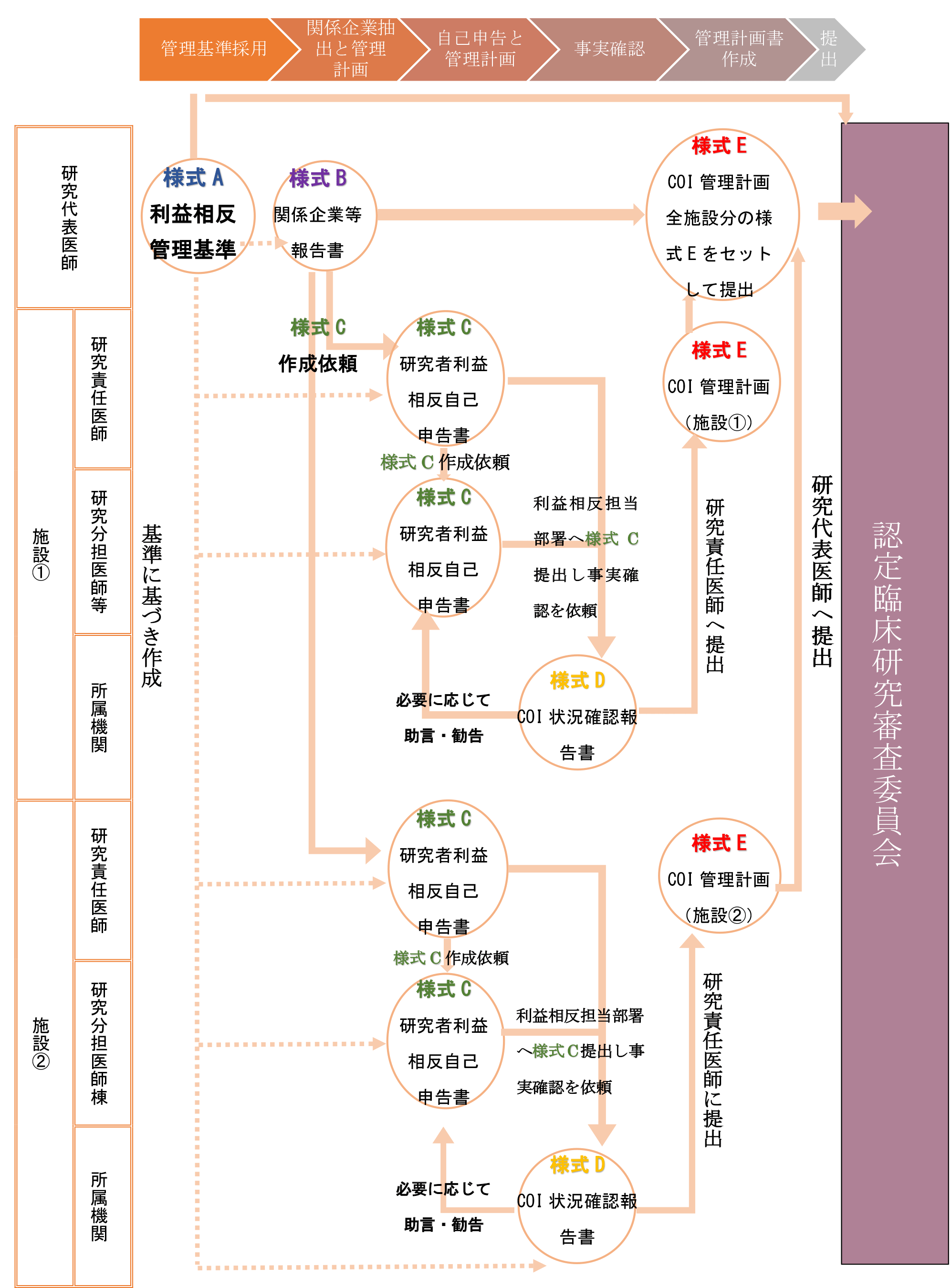
なお、多施設共同研究の場合は多少異なるプロセスとなる。具体的には、利益相反管理基準の採用と企業関与の内容については研究代表医師が一括して担当するが((1)及び(2))、その後の自己申告については各施設の研究責任医師を通じて研究分担医師等に依頼が行われ、施設ごとに利益相反管理計画書が作成されることになる((3)~(5))。その後、研究代表医師は作成された全施設分の利益相反管理計画書を取りまとめて認定臨床研究審査委員会に提出し、審査を受ける((6))。
臨床研究法における臨床研究の利益相反管理について(医政研発 0302 第1号)
単施設の場合
利益相反管理書類の提出は、研究開始時だけでなく1年ごとの定期報告時にも求められます。
利益相反申告書(研究責任医師、分担医師、統計解析責任者等)1名につきひとつのExcelファイルを作成していただくことになります。
図をクリックすると拡大します。
多施設共同研究の場合
利益相反管理書類の提出は、研究開始時だけでなく1年ごとの定期報告時にも求められます。
利益相反申告書(研究責任医師、分担医師、統計解析責任者等)1名につきひとつのExcelファイルを作成していただくことになります。
図をクリックすると拡大します。
利益相反に関する規定
利益相反管理に関しては、臨床研究法のほか、省令、通知、ガイダンス等で定められています。
- 臨床研究法 第3条(臨床研究実施基準)第2項第5号等関係
特定臨床研究に用いる医薬品等の製造販売をし、又はしようとする医薬品等製造販売業者及びその特殊関係者の当該特定臨床研究に対する関与に関する事項 - 臨床研究法施行規則 第21条(利益相反管理計画の作成等)
- 臨床研究法における臨床研究の利益相反管理について
(平成30年3月2日医政発0302第1号 厚生労働省医政局研究開発振興課長通知) - 臨床研究法における臨床研究の利益相反管理について
(平成30年11月30日医政研発1130第17号厚生労働省医政局研究開発振興課長通知) - 臨床研究法における利益相反管理様式A~E
- 臨床研究法における利益相反管理ガイダンスに関するQ&A
- 臨床研究法における利益相反管理に関する標準業務手順書
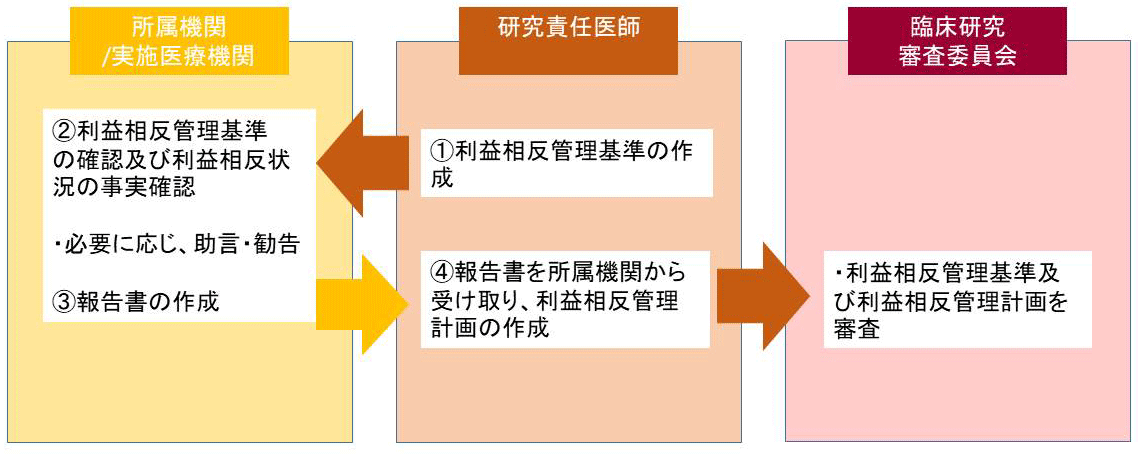
臨床研究法においては、研究責任医師が利益相反管理の責任を負うことが定められています。下図に示すように、研究責任医師は利益相反基準を作成し、当該基準に従って研究全体の利益相反の管理計画を作成し認定臨床研究審査委員に諮ることが求められます。
図をクリックすると拡大します。
- 研究責任医師または研究代表医師は、当該臨床研究の利益相反管理基準を作成し、当該臨床研究に関わる企業を確認する。
- 研究責任医師・研究分担医師等は、当該臨床研究に関わる企業との利益相反状況を確認し、所属機関が事実確認する。
- 所属機関は、確認内容を研究責任医師へ報告する。
- 研究責任医師または研究代表医師は、所属機関の報告を確認し、当該研究の利益相反管理計画を作成し、当該研究の利益相反管理基準とともに認定臨床研究審査委員会に申請する。
利益相反申告の対象となるのは、
・研究責任医師
・研究分担医師
・統計解析責任者
・研究実施によって利益を得る事が明白な者
です。
管理が必要となる利益相反は、
・研究への企業関与
・利益相反申告者と企業との関係
の2つです。
1、研究への企業関与(規則21条1項1号)
研究責任医師(他施設共同研究の場合は研究代表医師)は、実施する臨床研究に関与する企業を抽出し、関係性を整理して利益相反管理計画を示す必要があります。
以下の要件1~5のいずれかに該当する場合は、企業関与「有り」となります。
- 医薬品等製造販売業者等が製造販売をし、又はしようとする医薬品等を用いる研究
- 医薬品等製造販売業者等からの当該臨床研究に対する研究資金等の提供を受ける場合
- 医薬品等製造販売業者等からの当該臨床研究に使用する物品(医薬品等を含む)、施設等の無償又は相当程度に安価で提供・貸与を受ける研究
- 医薬品等製造販売業者から無償又は相当程度に安価な価格での役務及び特定役務を受ける研究
- 医薬品等製造販売業者等に在籍している者及び過去2年間在籍していた者が従事する研究
2、利益相反申告者と企業との関係(規則21条1項2号)
利益相反申告者は、研究対象薬剤等の製造販売業者との関係を申告し、基準に従って管理計画を立て、利益相反事務局の事実確認を受けることが必要となります。
下記事項について、本人及び生計を共にする配偶者、一親等親族の、当該年度と前年度についての申告が必要です。
- 1社からの寄附金が年間200万円以上(寄附金の管理者が報告する)
- 寄付講座所属
- 1社からの個人的利益が年間100万円以上(級と・講演・原稿・コンサル・ライセンス・贈答・接遇等による収入)
- 役員等への就任
- 株式保有・出資(株式については、公開株は5%以上、未公開株は1株以上、新株予約権は1個以上)
- その他(寄附講座の受入・特許権を保有している等)